无机物化教研室在化疗-光动力多模式肿瘤治疗方面取得新进展
发布时间:2024-12-27 浏览次数:0次
多种屏障阻碍了药物进入细胞的过程,进而限制了肿瘤药物治疗的有效性。在纳米治疗领域,实现药物的有效渗透至肿瘤组织并促进细胞摄取,对于提升治疗效果至关重要。光动力疗法(PDT)作为一种新兴的肿瘤抑制手段,在空间与时间的维度上均展现出高度的精确可控性,并已在临床癌症治疗中获得了正式批准。然而,传统的光敏剂(PS)往往具有芳香烃结构,这可能导致其溶解性不佳,且在生理环境中易于积聚,进而严重削弱其治疗效果。相比之下,纳米级PS凭借其规则且多孔的结构特性,能够维持高密度的PS分布,同时有效防止不必要的聚集,从而极大地促进了活性氧(ROS)的高效生成。
基于此,无机物化教研室王静教授团队成功研发了一种尺寸可调的基于卟啉的COF,并通过透明质酸(HA)的进一步修饰,实现了药物的顺序递送,以进行化疗-光动力联合肿瘤治疗(图1)。其中,尺寸较大的COF(P-COF,直径约为500 nm),用于装载抗纤维化药物氯沙坦(LST),从而构建了LST/P-COF@HA(LCH)复合物。该复合物能够在肿瘤部位有效积聚。注射后,LCH能够释放LST,进而降低肿瘤细胞外基质(ECM)的成分水平并减少胶原密度,有效缓解肿瘤的固体压力。此外,在660 nm激光的照射下,LCH能够产生ROS,诱导细胞膜的脂质过氧化反应。由于LCH的尺寸较大,它主要在细胞外发挥治疗作用,为后续的治疗步骤奠定了坚实的基础。在静脉给药后,使用装载有阿霉素(DOX)并用HA修饰的较小COF(p-COF,直径约为200 nm),即DOX/p-COF@HA(DCH),该复合物能够轻松进入已经发生改变的肿瘤微环境中的细胞。在肿瘤细胞内部,DCH产生的ROS能够增强PDT的效果,而释放的DOX则通过化疗手段靶向癌细胞。在谷胱甘肽(GSH)水平升高的情况下,DCH中的二硫键会发生断裂,从而触发化疗过程。同时,GSH的消耗进一步增强了PDT的疗效。通过充分利用卟啉COF的尺寸可调特性,构建了一个多功能的药物输送系统。该系统能够在最佳时机克服特定的治疗障碍,从而显著改善体内的化疗-光动力多模态肿瘤治疗效果。
该研究得到了国家自然科学基金、河北省自然科学基金和河北医科大学春雨计划(优青)等项目的资助与支持。相关工作“Engineering a porphyrin COFs encapsulated by hyaluronic acid tumor-targeted nanoplatform for sequential chemo-photodynamic multimodal tumor therapy”发表于International Journal of Biological Macromolecules(Int. J. Biol. Macromol. 2024, 279, 135328. IF = 7.7,SCI一区 Top)
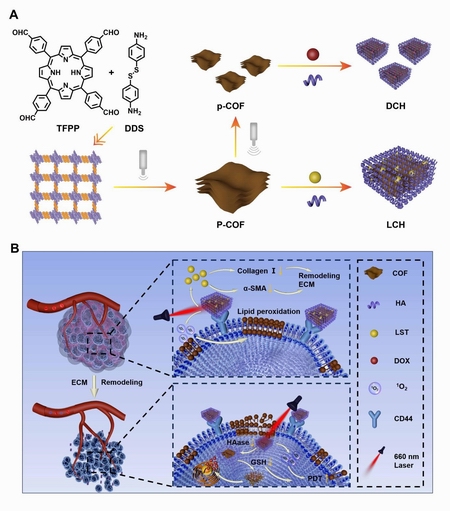
图1 合成示意图(A)与功能示意图(B)呈现一种用于细胞外基质重塑-化疗-光动力联合肿瘤治疗的纳米平台。


